8. juunil 2011 avaldatakse Euroopa Parlamendi ja nõukogu direktiiv 2011/62/EL – falcified medicines directive - mis kohustab Euroopa Liidu riike alates 9. veebruarist 2019 rakendama ravimite ehtsuse kontrolli süsteemi. Kohustus pannakse riikidele, kuid süsteemi ülesehitust ja edasist haldamist hakkab finantseerima erasektor ravimtootjate näol.
Hea lugeja
Sinu ees on REKSi (Ravimite Ehtsuse Kontrolli Sihtasutuse) esimene aastaraamat, mis annab ülevaate kõige olulisematest sündmustest süsteemi ja organisatsiooni loomisest kuni 2018. aasta lõpuni.
Samuti käsitleb aastaraamat ravimite ehtsuse kontrolli süsteemi juurutamisprotsessi, sisaldades süsteemi arenguid läbi REKSi partnerite ja seotud organisatsioonide tegevuste Eestis ning Euroopa tasandil.
REKS on Ravimite Ehtsuse Kontrolli Sihtasutus, asutatud 26. oktoobril 2016.
REKS asutajateks on Eesti Ravimitootjate Liit (RTL), Eesti Ravimihulgimüüjate Liit ja Eesti Apteekide Ühendus. Sihtasutuse tööd juhib ja korraldab kuueliikmeline nõukogu, mille esimees on alates 26. oktoobrist 2016 Riho Tapfer. Nõukogus on esindatud läbi Haiglate Liidu ka Haigla Apteekide Ühendus. Igapäevaselt juhib REKSi tegevust Raul Mill. REKSis töötab 2018. aasta seisuga 3 inimest. REKS tänab kõiki asutajaid ja nõukogu liikmeid sisulise ja suure panuse eest süsteemi ülesehitamisel. Samuti kuulub eriline tänu RTL-i liikmetele, kelle poolt võimaldatud laenude ja ettemaksete abil süsteemi ülesehitatamine võimalikuks sai.

- AbbVie Biopharmaceuticals GmbH Eesti filiaal
- AstraZeneca AB
- Bayer OÜ
- BGP Products Switzerland GmbH Estonian affiliate
- Boehringer Ingelheim RCV GmbH & Co KG Eesti filiaal
- Eli Lilly (Suisse) S.A, Rep Office Estonia
- Gedeon Richter Plc
- GlaxoSmithKline Eesti OÜ
- Lundbeck Eesti AS
- MSD HUMAN HEALTH HOLDING B.V.
- Novartis Pharma Services inc Eesti filiaal
- Novo Nordisk A/S
- OÜ Berlin-Chemie Menarini Eesti
- Pfizer Estonia OÜ
- Roche Eesti OÜ
- Sandoz Pharmaceuticals d.d
- Sanofi-Aventis Estonia OÜ
- Takeda Pharma AS
- UAB "JOHNSON & JOHNSON" Eesti filiaal
- UAB Sicor Biotech Eesti filiaal
Ülevaade ajaloost

Allkirjastatakse Memorandum of Understanding Efpia, PGEU ja GIRP vahel.

Allkirjastatakse Memorandum of Understanding teiste sidusrühmadega.
Toimub direktiivi ülevõtmine Euroopa Liidu liikmesriikide õigusaktidesse.
Töötatakse välja ravimite ehtsuse kontrollisüsteemi (EMVS) disain.
Valitakse välja süsteemi keskse andmekogu (EU-HUB) arendaja.
13. veebruaril asutatakse European Medicines Verification Organization (EMVO). EMVO on mittetulunduslik organisatsioon, mis haldab tsentraalset HUB-i ja koordineerib NMVO-de (National Medicines Verification Organization) tegevust. EMVO asutajad on Efpia, MfE, GIRP, EAEPC, PGEU.
3. oktoobril antakse välja Euroopa Komisjoni delegeeritud määrus (EL) 2016/161, millega täiendatakse Euroopa Parlamendi ja nõukogu direktiivi 2001/83/EÜ üksikasjalike eeskirjade kehtestamisega inimtervishoius kasutatavate ravimite välispakendil olevate turvaelementide kohta. Tegemist on otsekohalduva määrusega, mille liikmesriigid peavad rakendama. Määruses on sätestatud, et seda hakatakse kohaldama 9. veebruaril 2019.

Septembris allkirjastatakse Memorandum of Understanding hulgimüüjate, apteekide ja ravimitootjate poolt.

Tulenevalt kehtestatud nõuetest hakkavad kõik ravimpakendid kandma turvamärgist, mille andmed edastatakse loodavasse infosüsteemi.

Lisaks on pakenditel kohustuslik kasutada ka avamisvastast turvaelementi “tamper evidence”.
9. veebruaril avaldatakse delegeeritud aktid, mis jätavad süsteemi loomiseks aega 36 kuud.
Tulenevalt direktiivi ja määruse nõuetest, on iga liikmesriigi ravimi müügiloahoidjate kohustus asutada mittetulunduslik organisatsioon - NMVO - koostöös hulgimüüjate ning apteekidega ja luua riigipõhine ravimite turvaelementide andmekogu.
Võltsravimite direktiiv (FMD) peab täielikult rakenduma 09.02.2019.
Eesmärkkaitsta patsiente legaalses tarneahelas võltsravimite eest
Sisuüle-euroopalise ravimite ehtsuse kontrolli süsteemi loomine
-
Juuli 2011
Võltsravimite direktiivi avaldamine
-
-
09.02.2016
Delegeeritud aktide avaldamine
-
-
09.02.2019
Täielik rakendamine
Mittevastavus tähendab, et ravimeid ei saa legaalselt patsientidele tarnida.
26. oktoobril asutatakse Ravimite Ehtsuse Kontrolli SA ehk REKS.
Oluline ja edukaks osutuv otsus on, et REKSi asutajateks on kõik süsteemi rakendumiseks olulised osapooled – ravimtootjad, hulgimüüjad ja apteegid, sh. haiglaapteegid.
Osapooltel on järgnevad kohustused:
Tootjad loovad ravimitele uued turvalised pakendid ja iga pakend varustatakse unikaalse turvamärgise ning avamisvastase seadmega;
Hulgimüüjatel ja apteekritel peab olema tehniline valmidus skänneerida pakendile lisatavat 2D koodi ja võimalus kontrollida seda läbi loodava riigipõhise andmekogu;
Liikmesriikide ülesanne on projekti nõustamine ja järelevalve, samuti seadusandluse vastavusse viimine direktiivi ning määruse nõuetega.
Alustatakse läbirääkimisi arendajatega (tehniliseks lahenduseks on Blueprint) .
Süsteemi ülesehitust finantseeritakse laenude ja ettemaksetega, mida Eestis tagavad RTL-i liikmed. Lisaks teevad asutajad süsteemi ülesehitamise perioodil omapoolsed sissemaksed.
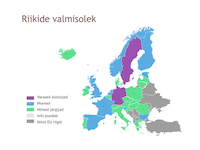
Riikide valmisolek süsteemi rakendamisel on erinev. EMVO kaardistab riikide valmisoleku ravimite ehtsuse kontrolli süsteemi rakendamise osas.
Moodustatakse projekti juhtgrupp.
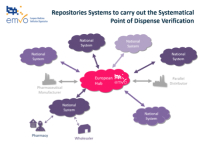
Süsteemi arhitektuur näeb ette, et keskse andmebaasi osa ehk EU-HUB’i vahendusel hakkab toimuma andmete üleslaadimine riikide repositooriumitesse. Samuti toimub kogu riikidevaheline andmevahetus üle EU-HUB’i.
Süsteemiga ühineb 32 riiki.
Hinnanguliselt liidestub süsteemiga 2500 ravimtootjat ja ümber tuleb kujundada ca 10.5 miljardit serialiseerimisele kuuluvat ravimipakendit.
Süsteemi arendusi hakkavad teostama kaks arendajat: Bertelsman gruppi kuuluv Arvato ja Solidsoft. Kõik riigid teevad oma valiku nende kahe arendaja vahel.
Eesti süsteemi hakkab arendama Arvato. Kokku valivad Arvato oma arenduspartneriks 16 riiki. Leping allkirjastatakse Arvatoga 29. detsembril 2017, mis on ka ametlikult Eesti poolse süsteemi arenduse algusaeg.

Novembris toimub Tallinnas Kultuurikatlas Rahvusvaheline FMD rakendamisele suunatud seminar, mille korraldaja on RTL.

Konverentsi eel näeb ilmavalgust REKSi koduleht koos uue visuaalse identiteediga.
Novembris toimub Tallinnas Arvato osavõtul seminar süsteemi tulevastele kasutajatele.
Detsembris toimub Berliinis Arvato poolt korraldatud serialiseerimise sümpoosion. Lisaks ettekannetele toimuvad sümpoosionil ka praktilised töötoad, kus arutatakse süsteemi implementeerimise võtmeküsimuste üle.
Ja siis jõudis kätte aasta 2018
Paigas on süsteemi arhitektuur ja kontseptuaalne ülesehitus. Süsteem koosneb kesksest EU-HUB’st, mille kaudu laevad ravimitootjad/müügiloahoidjad üles ravimipakendite turvaelementide andmed.
EU-HUB’ga on ühendatud iga riigi vastav andmekogu, kuhu andmed liiguvad vastavalt sellele, millisele turule/sihtriiki nad on määratud. Üle EU-HUB’i hakkab vajadusel toimuma ka infovahetus erinevate riikide repositooriumite vahel.

Ravimipakendi turvaelemendi andmed laetakse tootja või tema esindaja poolt üles kesksesse EU-HUBi, mille kaudu jõuab pakendi andmed sihtriigi andmekogusse. Lõppkasutaja kontrollib enne pakendi väljastamist ravimipakendi ehtsust skänneriga või manuaalselt vastu sihtriigi andmekogu. Kõikides riikides on protsess samasugune.

REKSi meeskond kasvab kolmeliikmeliseks ja kontor kolib Tartu maanteel asuvasse Fahle majja.
Jaanuaris korraldab Arvato Viinis oma klientidele kohtumise, kus arutatakse läbi algava aasta tegevuskava ja arendust puudutavad üksikasjad.
Aasta vältel toimuvad EMVO poolt korraldatavad projektijuhtimise koosolekud, kus jagatakse infot kõigile süsteemiga liitunud riikidele, peamiselt EMVO vahendusel. Lisaks toimuvad Brüsselis EMVO ja Efpia ühistööna korraldatud süsteemi ülesehituse võtmeküsimusi puudutavad koosolekud.

Igakuiselt jagab EMVO ülevaadet süsteemi juurutamise arengutest liikmesriikide lõikes.
18. veebruaril allkirjastatakse leping EMVO-ga. Tegu on koostöölepinguga, mis sõlmitakse vaid arendusfaasi ajaks ehk kuni süsteemi rakendamiseni.

Märtsis korraldab REKS kõigile süsteemi osapooltele infopäevad, mis toimuvad Tallinnas ja Tartus. Infopäevade raames tutvustatakse asjaosalistele FMD rakendamiseks ja süsteemiga liidestumiseks vajalikke tegevusi. Tutvustatakse projekti ajakava ja antakse lühiülevaade toimuvast ning arutatakse tekkinud küsimuste ja probleemkohtade üle.

Märtsis toimuvad kasutajatestid ehk UAT (user acceptance tests). Testid viiakse läbi Arvato arenduskeskuses Gütersloh’is Saksamaal, Arvato ja Soome NMVO (FiMVO) koostöös. Kohal on ka teiste riikide NMVO'de esindajad, kes hakkavad kasutama Arvato lahendust.

Apteekide ja hulgimüüjate tarkvaraarendajatele valmib Arvato poolne portaalilahendus, mille kaudu saavad nad ligipääsu liidestamiseks vajalikule tehnilisele dokumentatsioonile. Hiljem saab sama keskkonna kaudu läbida ka lõppkasutajatele suunatud Baseline testimise.
2018 aasta alguses on 16 riiki sõlminud arenduslepingu Arvatoga. Koostöö riikide vahel on tihe. Toimuvad regulaarsed iganädalased Skype koosolekud, lisaks igakuised silmast silma kohtumised. Kohtumistel arutatakse arendustega seotud küsimusi ning jagatakse kogemusi süsteemi ülesehitamise kohta.
REKS viib vastavusse EMVO poolt nõutud ulatuses kvaliteedisüsteemi juurutamise ja läbib selles osas ka ettenähtud hindamise. Kvaliteedisüsteemi juurutamine on eelduseks Eesti andmekogu testkeskkonna ühendamiseks EU-HUB’ga.
Sotsiaalministeerium ja Ravimiamet teevad ettevalmistusi ravimiseaduse muutmiseks. Lisaks REKSi korraldatavatele koolitustele, käsitleb ka Ravimiamet oma korraldatavatel seminaridel riikide NMVO'de liitumist puudutavaid teemasid.
Kvartaalselt edastab REKS kõigle osapooltele infokirja süsteemi arenduste hetkeseisu ja ajakavas püsimise kohta, sh seotud lõppkasutajate infosüsteemide arenduste ja organisatsioonide valmisoleku osas.

Aprillis ühendatakse Eesti testkeskkond (IQE) EU-HUB’ga. Eesti süsteemi osapooled saavad alustada testimist.
Aprillis kinnitab REKS nõukogu 2019. aasta finantsmudeli. Sellele eelnevad mitmed kohtumised müügiloahoidjatega, kus kuulatakse ära ettepanekud ja mured kehtestatavate tasude osas ning arutatakse läbi erinevad finantseerimismudelite võimalused. Finantsmudeli väljatöötamisel võetakse prioriteediks ravimite kättesaadavuse tagamine Eesti turul, kus arvestada tuleb ka väiksema käibega müügiloahoidjate võimekust süsteemiga liidestuda.
Eesti võtab kasutusele nn kohandatud flat fee mudeli, kus arvesse võetakse ettevõtete käibepõhiseid erandeid. Olulise punktina ei kehtestata müügiloahoidjatele süsteemiga liidestumise tasusid, mida paljud riigid kasutavad.
Mais toimub Tallinnas arendajatele mõeldud infopäev, kus osaleb ka Arvato. Infopäeval arutatakse läbi lõppkasutajate liidestmiseks vajalikud tehnilised nüansid, sh vajalike sertifikaatide kasutamine lõppkasutajate arvutites.
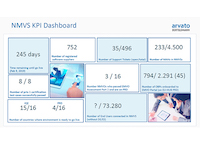
Progress süsteemi arendamisel.
Juunis alustab REKS müügiloahoidjatega lepingute sõlmimist. Tegemist on pika protsessiga, mis kestab aasta lõpuni ning jätkub ka 2019. aastal.
Juunis läbib REKS teise EMVO kvaliteedisüsteemi hindamise, mis on eelduseks Eestipoolse nn. live keskkonna (PROD) ühendamiseks EU-HUB’ga. Tootmiskeskkonna ühendamine on planeeritud 29. juuliks 2018. Siiski, juba 30. juunil ehk kuu planeeritust varem on Eesti tootmiskeskkond EU-HUB’ga ühendatud ja müügiloahoidjatele avatud andmete üleslaadimiseks . Esimesed, ühe partiiga seotud 16 toote andmed laetakse üles juulis 2018. 1. septembriks 2018 on tootmiskeskkonda lisatud andmed 269 partii ja 190 tootenimetuse kohta.
Juunis valmib Baseline testimise lahendus lõppkasutajatele. Esimesed testid viiakse läbi augustis. Esimesena läbib testi tarkvara - NOOM Pharmacy Version (arendaja: Apteekide Infotehnoloogia OY) Testi läbijad saavad vastava sertifikaadi.

Ravimite ehtsuse kontrollimine apteegis.
REKS töötab välja kasutajakontode halduse süsteemi. Tulenevalt süsteemi tehnilistest nõuetest, peab iga kasutaja alla laadima sertifikaadi ja selle oma arvutis installeerima. REKS loob kontod lõppkasutaja admin kasutajale. Sujuvamaks sertifikaatide installeerimiseks pakub REKS lisaks koostatud juhenditele ka online kasutajatuge nii arvuti kui ka telefoni vahendusel.
Juulis alustab REKS süsteemi kasutamiseks mõeldud lepingute sõlmimist lõppkasutajatega. Kokku sõlmitakse müügiloahoidjate ja lõppkasutajatega (juriidilised isikud) üle 300 lepingu, mille alusel on süsteemiga võimalik liidestuda enam kui 700 osapoolel.

Esimene lõppkasutaja liidestub süsteemi testkeskkonnaga augustis ning tootmiskeskkonnaga novembris.
Novembris edastab REKS täiendavad infokirjad kõigile süsteemi osapooltele.
2018. aasta II poolaastal edastatakse mitmeid märgukirju ja helistatakse läbi lepingupartnerid, et kindlustada kõigi kasutajate, müügiloahoidjate, apteekide, haiglaapteekide ja hulgimüüjate, õigeaegne liidestamine.
Detsembris hakkab REKS tegema ettevalmistusi jaanuaris 2019 toimuvaks seminariks “FMD rakendamine 9.veebruaril 2019”.

Detsembris võetakse Riigikogus vastu ravimiseaduse muutmise seadus.
2018. aasta olulisemad märksõnad
-
I poolaasta lõpuks on valmis REKSi live keskkond.
-
90%
90% lõppkasutajatest on sõlminud REKSiga lepingu.
-
886
Süsteemi on üles laetud andmed 886 partii kohta.
-
1232
Süsteemi on üles laetud andmed 1232 tootenimetuse kohta.
Lõppsõna
,,Täname kõiki osapooli nende panuse eest süsteemi ülesehitamisel. Ravimtootjaid, kes kujundasid ümber tootmisliinid, et uued pakendid saaksid varustatud turvaelementidega ja lõppkasutajaid, kes teostasid vajalikud arendused süsteemiga liidestumiseks ning kujundasid ringi oma tööprotsessid. Kogu süsteem suudeti valmis ehitada planeeritud 36 kuuga. Tähelepanuväärne on ka asjaolu, et kõik EL riigid (v.a. paar erandit), lisaks ka Norra ja Šveits ning Liechtenstein, võtsid süsteemi kasutusele ettenähtud ajaks – 9. veebruaril kell 00.00 Kesk-Euroopa aja järgi. Selliseid süsteeme on vähe, kus kogu Euroopa võtab kasutusele piiriüleselt toimiva süsteemi minutipealt. Kindlasti väärib esiletõstmist süsteemi kontseptuaalne ülesehitus – süsteem on rahastatud, väljaarendatud ning hallatud täielikult erasektori poolt ja nende vahenditest, kuigi direktiivist tulenevalt on selle rakendamise kohustus pandud riikidele.
REKS on oma kolme töötajaga väike organisatsioon ja ehk seetõttu oli algselt meil keeruline aduda kui laiaulatuslik on süsteemi ülesehitamine ja töölerakendamine. Mastaapne see loodud süsteem täna aga on. Ainuüksi 2019. aasta mai viimasel kahel nädalal kontrolliti Euroopas süsteemiga liitunud riikide poolt kokku üle 100 miljoni ravimipakendi, Eestis samal perioodil ligi pool miljonit ravimit. Selle eduka tulemuse aluseks on olnud väga tihe ja efektiivne koostöö kõikide osapoolte vahel. Tegu on äärmiselt konstruktiivsete, viisakate ja töökate inimestega, kes on orienteeritud tulemuste saavutamisele. 16 riiki, kes on Arvatoga seotud, on näiteks kiireks suhtluseks loonud WhatsApp grupi, et infovahetus saaks toimuda 24/7. Väga hea koostöö tõenduseks on üleeuroopalise IT-arenduse valmimine vähem kui ühe aastaga, mis sarnaste projektide puhul on enam kui tähelepanuväärne.
Lõpetuseks tahaksin etteruttavalt öelda, sest oleme ju praegu juba aastas 2019, et kui aasta 2018 tundus ja oligi väga sisutihe ning arenduse mõttes ka pingeline, siis suur hulk tööd on alles ees. 2019. aasta algusest rakendunud süsteemi live kasutus on sellest juba märku andnud, kuid nii heade partneritega on kõik eesmärgid saavutatavad.”
– Raul Mill, REKS juhatuse esimees